2023-04-20 10:14 来源:昭通新闻网

近年来,电化学知识在全国卷和自主命题省卷中出现的概率均为100%,属于必考题。这类题承载着对电化学原理的考查,体现化学在解决能源问题中的重要作用。试题考查方向:一是原电池工作原理的应用;二是电解池工作原理的应用;三是二次电池;四是多池的串联。高频考点主要集中在判断电极名称、判断离子和电子的移动方向、判断电极反应式和总反应式的正误、判断电解质溶液的变化、判断隔膜的类型及作用、判断电极产物以及定量计算等,其中电极反应式和总反应式正误的判断属于必考点。
此类题难度不大,但是考生得分率却不高。其实电化学所涉及的核心知识点相对较少,只要考生掌握相关基础知识、具备解题的关键能力,极易在短时间内突击拿分。本文将通过一道高考题对电化学这部分的常考点进行复习归纳,希望能对考生有所帮助。
【例】(2022·全国乙卷)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电Li-O2电池(如图所示)。
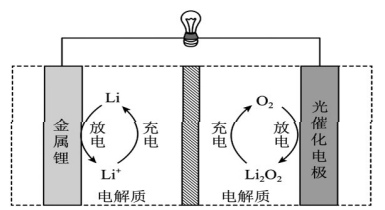
光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-=Li)和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电。下列叙述错误的是( )
A.充电时,电池的总反应Li2O2=2Li+O2
B.充电效率与光照产生的电子和空穴量有关
C.放电时,Li+从正极穿过离子交换膜向负极迁移
D.放电时,正极发生反应O2+2Li++2e-=Li2O2
本题以可进行光照充电的Li-O2电池作为情境,该电池为近年来的研究成果,属于新型电池装置,且充电方式也非常新颖,但考查的知识点还是原电池和电解池工作原理等必备知识,同时考查了学生信息获取与加工能力、逻辑推理与论证能力和批判性思维能力。
试题分析:本题通过题给图示可判断充电时光催化电极为阳极,Li2O2失电子生成O2,金属锂为阴极,Li+得电子生成Li,则充电时总反应为Li2O2=2Li+O2,A正确。放电时锂为负极,Li失电子生成Li+,光催化电极为正极,O2在正极得电子生成Li2O2,则放电时正极反应为O2+2Li++2e-=Li2O2,D正确。
链接基础:一、电极反应式的书写——找两物、定得失、判电荷、查守恒
(1)原电池电极反应式的书写步骤
第一步:分析化学反应,明确氧化剂和还原剂,写出化合价变化的微粒。第二步:根据得失电子守恒确定变价微粒系数。第三步:分析电解液的酸碱性,再利用H+(酸性)或OH-(碱性)配平电荷,最后利用水使原子守恒。
(2)电解池电极反应式的书写步骤
第一步:明确电解池阴阳极电极材料及溶液中存在的离子。第二步:根据离子放电顺序,确定放电离子。第三步:根据氧化还原反应规律写出阴阳两极电极反应式和电解总反应方程式。
注意:(1)让两电极反应的得失电子数相同,然后将两电极反应式相加即可得到总反应方程式。
(2)燃料电池在正极发生还原反应的物质一般都是O2,则正极反应式:①酸性溶液,O2+4e-+4H+=2H2O;②碱性溶液,O2+4e-+2H2O=4OH-;③熔融氧化物,O2+4e-=2O2-;④熔融碳酸盐,O2+4e-+2CO2=2CO32-,然后利用电池总反应式和正极反应式写出负极反应式。
(3)牢记电解池中阴阳极微粒的放电顺序。①阳极放电顺序:若是活性电极(金属活动顺序表Ag及以前金属)作阳极,则是电极本身失电子放电。如:Fe-2e-= Fe2+ 或Cu-2e-= Cu2+;若是惰性电极(Pt、Au、石墨)作阳极,则是溶液中的阴离子放电。常见阴离子的放电顺序是:S2->I->Br->Cl-> OH-。②阴极放电顺序:常见阳离子的放电顺序为Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>A13+>……>K+。
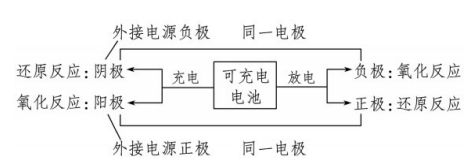
二次电池的电极反应关系——先原电,后电解,负变阴,正变阳。
试题分析:题给信息“光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-=Li)和阳极反应(Li2O2+2h+=2Li++O2)对电池进行充电”,说明充电效率与光照产生的电子和空穴量有关,B正确。
放电时,金属Li电极为负极,光催化电极为正极,Li+从负极穿过离子交换膜向正极迁移,C错误。
链接基础:二、原电池和电解池的工作原理
(1)定义:将化学能转变为电能的装置叫做原电池,将电能转变为化学能的装置叫做电解池。
(2)工作原理——阳负失升氧,阴正得降还。
①判断原电池的正负极。负极:较活泼金属,发生氧化反应,电子流出的电极。正极:较不活泼的金属(或石墨),发生还原反应,电子流入的电极。
②判断电解池的阴阳极。阳极:与电源正极相连的电极,失去电子,发生氧化反应的电极。阴极:与电源负极相连的电极,得到电子,发生还原反应的电极。
③电子移动方向——电子不下水、离子不上岸。原电池:电子由负极通过外电路流向正极。电解池:电子从电源负极流向阴极,再由阳极流向电源正极。
④离子移动方向——电解池异性相吸,原电池同性相恋。原电池:阳离子向正极移动,阴离子向负极移动。电解池:阳离子向阴极移动,阴离子向阳极移动。
链接基础:三、离子交换膜
电解时,为了保证电极反应正常进行,阻止两极区产生的物质接触,防止发生化学反应,常常将阴阳极用离子交换膜隔离开,使电解池变成两室(或三室)电解池。若为阳离子交换膜只允许阳离子通过;若为阴离子交换膜只允许阴离子通过;若为质子交换膜只允许氢离子通过,不允许其他阳离子和阴离子通过。
总之,电化学试题属于必考题,在备课时要引起足够的重视。不论多么复杂陌生的情境都离不开教材中原电池和电解池的模型,所以考生一定要回归教材,重视基础知识、重视常考点。通过做近几年的高考试题感知高考考查要求,查找知识掌握和能力要求上的不足,有针对性地复习并不断提高解题能力。
教师简介:
陈文涓,昭通市第一中学高级教师,从教20年,担任班主任工作12年,所带高617班荣获2021~2022年度“云南省级先进班集体”光荣称号。担任年级化学备课组组长、昭通市2023届复习备考化学学科中心教研组组长,参与了1个省级课题、1个市级课题的研究。2022年被评为“昭通市中小学骨干教师”,多次被评为“优秀教师”。多次承担市统测的命题、审题工作。


